
















































Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity

Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium


Prepara tus exámenes
Prepara tus exámenes y mejora tus resultados gracias a la gran cantidad de recursos disponibles en Docsity
Prepara tus exámenes con los documentos que comparten otros estudiantes como tú en Docsity
Los mejores documentos en venta realizados por estudiantes que han terminado sus estudios
Estudia con lecciones y exámenes resueltos basados en los programas académicos de las mejores universidades
Responde a preguntas de exámenes reales y pon a prueba tu preparación

Consigue puntos base para descargar
Gana puntos ayudando a otros estudiantes o consíguelos activando un Plan Premium
Comunidad
Pide ayuda a la comunidad y resuelve tus dudas de estudio
Descubre las mejores universidades de tu país según los usuarios de Docsity
Ebooks gratuitos
Descarga nuestras guías gratuitas sobre técnicas de estudio, métodos para controlar la ansiedad y consejos para la tesis preparadas por los tutores de Docsity
estres oxidativo .....................
Tipo: Resúmenes
1 / 56

Esta página no es visible en la vista previa
¡No te pierdas las partes importantes!

















































QFB.Delia Karina Huitron Velazquez SEP-OCT- 2021
La regeneración de especies reactivas de oxigeno (ERO) a partir del O 2 en las células es un fenómeno natural y cotidiano. Los electrones que contribuyen a su formación por lo general se derivan de portadores de electrones reducidos de la cadena de trasporte de electrones. Las ERO se forman como productos accidentales de reacciones enzimáticas y no enzimáticas. En ocasiones se sintetizan de manera deliberada en reacciones catalizadas por enzimas. La radiación ultravioleta y los contaminantes del aire aumentan la formación de compuestos tóxicos que contienen oxigeno.
Radicales libres (RL) Los radicales libres son moléculas capaces de existir de forma independiente conteniendo en su última orbita uno o más electrones desapareados, los cuales le otorgan a estas carácter paramagnético que las torna muy inestables y altamente reactivas con capacidad para combinarse inespecíficamente, con las diferentes moléculas que integran la estructura celular y los derivados de estas, y con la capacidad de atacar cualquier tipo de biomolecular. Por su configuración electrónica estos radicales presentan una vida media corta. Sin embargo, en diversos estudios, se ha demostrado que la reactividad de estas moléculas se correlaciona inversamente con su vida media y capacidad de difusión en el medio celular.
● Los radicales libres se pueden formar a partir de diversos mecanismos, siendo la adición de un electrón a una molécula estable el más común. Una vez que estos son formados, buscan el modo de conseguir una configuración electrónica estable, razón por la cual interactúan con otras moléculas a través de reacciones de óxido reducción (redox). En dichas circunstancias, hay una transferencia de electrones que necesariamente implican la reducción (ganancia de electrones) y oxidación (perdida de electrones) de las moléculas participantes. ● Dicho mecanismo genera que la producción de radicales libres sea una reacción en cadena, ya que al reaccionar un radical libre con una molécula no radical inevitablemente esta última pasa a ser un RL. Dicha reacción en cadena solamente se detendrá cuando dos radicales libres se encuentren y reaccionen entre sí. Estas reacciones bioquímicas se encuentran clasificadas en tres grupos:
COVID- 19
Reacciones de iniciación. Es la formación de un radical libre a partir de no radicales. AB + C→ A• + D + E Reacciones de propagación. Consisten en la formación de un radical libre cuando reacciona una molécula estable con un radical libre. A• + CD → AC + D• Reacciones de terminación. Hace referencia a la reacción química entre dos radicales libres, en donde sus electrones desapareados son cancelados y se genera un producto estable A• + D• → AD
COVID- 19
COVID- 19
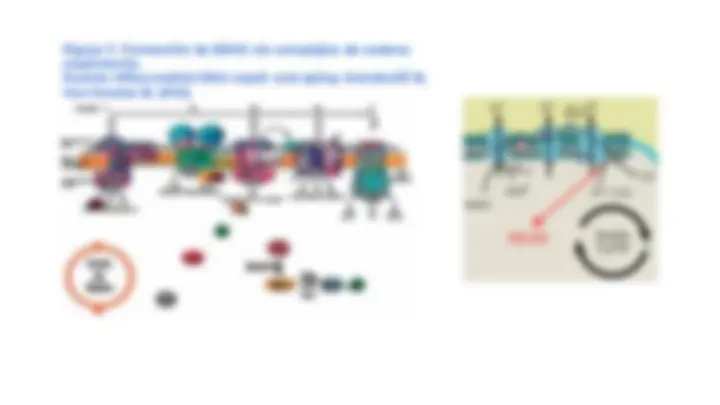
● Diferentes estudios se ha encontrado que el oxígeno puede llegar a ser toxico, cuando los seres vivos se exponen a altas concentraciones por encima de los niveles atmosféricos, lo que puede conllevar a danos tanto reversibles como irreversibles, llegando hasta la muerte celular. ● Dicho efecto nocivo involucra el proceso de reducción parcial del oxígeno, mediante el que se obtienen las especies reactivas de oxigeno (EROS). Estas moléculas pueden convertirse en peligrosos productos del metabolismo celular, debido a que cuando se rompe el equilibrio entre sustancias prooxidantes (EROS) y sustancias antioxidantes se genera estrés oxidativo y por ende diversos procesos patológicos, Figura 1
Figura 1. Respuesta celular frente a la formación de EROS a través de estímulos fisiológicos
COVID- 19
En su estado natural, el oxígeno es un bi-rradical; lo que indica que posee dos electrones desapareados en los orbitales p anti ligantes, con el mismo número cuántico de espín, que evita que reaccione como un radical libre y le confiere la característica de ser un elemento altamente oxidante. Es decir, que le permite aceptar electrones de otras moléculas.
● De igual forma, el oxígeno solamente puede reaccionar con moléculas que posean una configuración electrónica semejante a la suya. Razón por la cual queda impedido (por restricción de spin) para reaccionar con la mayoría de moléculas existentes, ya que estas no son bi-rradicales, evitando de esta manera que se lesionen ciertos blancos celulares importantes. Así mismo, en los procesos de transferencia de electrones o de absorción de energía se pueden generar las especies reactivas de oxigeno que involucran, tanto a los radicales libres de oxigeno como a las moléculas no radicales derivadas de este mismo elemento, que aunque no son RL poseen la capacidad de generar RL, Tabla 1.
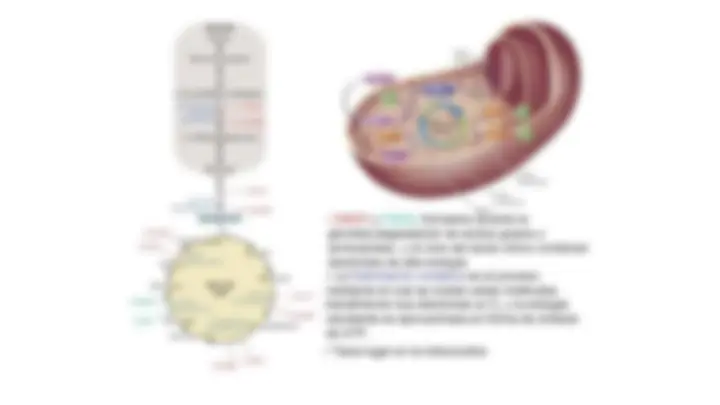
● Cuando el oxígeno oxida un compuesto este se reducirá gracias a la ganancia de electrones (un electrón por vez), es decir, al adicionar un electrón al oxigeno cuando este se encuentra en estado fundamental se forma el anión superóxido (O 2 - ), si se añade otro electrón como producto se obtendrá el anión peróxido, el cual no es un radical libre ya que no posee electrones desapareados.
● De la misma forma, cuando se da la reducción parcial del oxígeno por aceptación de dos electrones se da paso a la formación de peróxido de hidrogeno (H 2 O 2 ). Sin embargo, la unión que se da entre O-O en el peróxido de hidrogeno es muy débil y se puede llegar a descomponer dando así origen al radical hidroxilo (HO), el cual posee una alta reactividad. Sin embargo, cuando el oxígeno acepta cuatro electrones se forma una molécula de agua (H 2 O), Figura 2. ● El oxígeno en el proceso de reducción parcial también puede absorber energía de nuevo y pasar a un Estado excitado de mayor reactividad y energía, denominado oxigeno singlete.
COVID- 19