






















Study with the several resources on Docsity

Earn points by helping other students or get them with a premium plan


Prepare for your exams
Study with the several resources on Docsity

Earn points to download
Earn points by helping other students or get them with a premium plan
Community
Ask the community for help and clear up your study doubts
Discover the best universities in your country according to Docsity users
Free resources
Download our free guides on studying techniques, anxiety management strategies, and thesis advice from Docsity tutors
El documento presenta la practica de laboratorio
Typology: Schemes and Mind Maps
1 / 29

This page cannot be seen from the preview
Don't miss anything!






















Conceptual.
Desarrollar los conocimientos para comprender el fenómeno de la separación de
líquidos volátiles, por medio de la destilación de una mezcla binaria en una
columna adiabática de rectificación por lotes, combinando y comparando los
resultados experimentales con los teóricos calculados a partir de la ecuación de
Rayleigh y poder predecir los tiempos de operación, las masas y concentraciones
obtenidas.
Procedimental.
Realizar los diagramas de equilibrio binario de los sistemas: etanol-agua, como
solución ideal gas ideal y solución no ideal-gas ideal.
El alumno deberá desarrollar un diagrama de bloques de los pasos a seguir, la
secuencia y lógica de la operación correcta del equipo instalado en el laboratorio
para esta práctica.
Actitudinal.
Observar una conducta adecuada durante la realización de la práctica exhibiendo
una disciplina profesional. Realizar una investigación en las referencias disponibles
sobre las diferentes aplicaciones del proceso de destilación.
Tabla 4. Datos a Reflujo Constante
Corte 1 t ( min ) V
D 1
ρ
D 1
(
g
c m
3
)
W −D 1
n−D 1
Destilado 1 10
0.325 0.808 0.9025 0.
Corte 2 t ( min )
D 2
( L ) ρ
D 2
(
g
c m
3
)
W −D 2
n−D 2
Destilado 2 10 0.42 0.803 0.925 0.
Corte 3
t ( min ) V
D 3
ρ
D 3
(
g
c m
3
)
W −D 3
n−D 3
Destilado 3
10
0.31 0.801 0.93 0.
Residuo 3 0.3061 0.969 0.165 0.
t ( min )
ρ
Dprom
(
g
c m
3
)
W −Dprom
n−Dprom
10
0.804 0.92 0.
V L
(
min
)
Experimental
30
Cálculos Experimentales
a) A partir de las lecturas obtenidas del Diagrama 1 obtener las respectivas
composiciones mol del etanol para cada condición:
Datos:
2
H 2
O
= 18 kg / kmol
1
etanol
=46.08 kg/ kmol
x
n i
x
etanol−i
etanol
x
H 2 O−i
H 2 O
x
etanol−i
etanol
… … … … fórmula( 1 )
Alimentación (Hervidor):
x
n , etanol
Destilado
x
L−RT
Residuo
x
W −RT
Corte 1 - Destilado 1:
x
D 1
Corte 2 - Destilado 2:
x
D 2
Corte 3 - Destilado 3:
x
D 3
Residuo 3:
x
W 3
Cálculos Teóricos
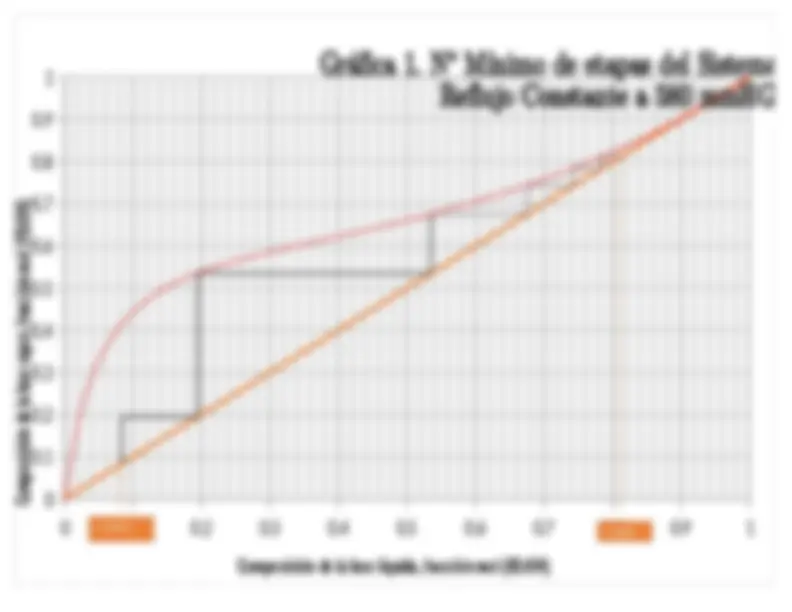
columna utilizando McCabe Thiele (Gráfica 1):
0 RT
m
PR
∗ 100 … … … … fórmula( 2 )
0
RT
reflujo constante:
a) Determinamos los moles para cada corte:
D 1
=x
D i
1
(
1 −x
D i
)
2
… … … … fórmula( 3 )
D i
D i
∗ρ
D i
D i
… … … … fórmula( 4 )
Para el corte 1:
D 1
=x
D 1 , 1
1
(
1 −x
D 1
)
2
D 1
kg
kmol
D 1
D 1
∗ρ
D 1
D 1
(
kg
)
kg
kmol
=6.5685465 x 1 0
− 3
kmol
Para el corte 2:
D 2
=x
D 2 , 1
1
(
1 −x
D 2 , 1
)
2
D 2
kg
Kmol
D 2
D 2
∗ρ
D 2
D 2
(
kg
)
kg
kmol
=8.18518774 x 1 0
− 3
Kmol
Para el corte 3:
D 3
=x
D 3 , 1
1
(
1 −x
D 3 , 1
)
2
D 3
Kg
Kmol
D 3
D 3
∗ρ
D 3
D 3
(
kg
)
Kg
Kmol
=5.9787333 x 1 0
− 3
kmol
b) Ahora, determinamos los moles promedio de la operación, el gasto de
destilado, la fracción mol promedio de la mezcla destilada y
posteriormente la fracción peso:
T
1
2
3
… … … … fórmula( 5 )
D
Cal
T
t
D 1
+t
D 2
+t
D 3
… … … … fórmula( 6 )
x
D−Total
D 1
∗x
D 1
D 2
∗x
D 2
D 3
∗x
3
T
… … … … fórmula( 7 )
x
DTotal
x
DTotal
1
x
DTotal
1
(
1 −x
DTotal
)
2
… … … … fórmula( 8 )
Sustituyendo :
T
=( 6.568546+8.1851877+5.978733)=20.732468 x 1 0
− 3
kmol
D
Cal
20.732468 x 1 0
− 3
kmol
( 10 + 10 + 10 ) min
=0.6910822 x 1 0
− 3
kmol
min
x
DTotal
6.568546 kmol∗0.78392+8.185188 kmol∗ 0 .828584+5.978733 kmol∗0.
20.732468 kmol
x
DTotal
x
DTotal
g
mol
g
mol
x
D T
ecuación de Coley (fórmula 9) a la misma composición
x
D 1
y a la
temperatura del termopar 9 y 10 respectivamente
ρ
Dm
i
( ° C )−96.7916∗x
D T
2
−100.061∗x
D T
i
( ° C )∗x
D T
i
( ° C )∗x
kmol
min
0.6910822 x 1 0
− 3
kmol
min
Por lo tanto para BZE:
x
D Total
… … … … fórmula( 13 )
teóricas:
poder obtener un resultado confiable. De esta forma, se emplea la ecuación
de Raylaight con la cuál compararemos los resultados experimentales que
obtuvimos. Por esto mismo, primero es necesario comenzar a suponer valores
de composición de destilado
x
DS−i
los cuáles nos servirán para calcular la
función esencial que, posteriormente, nos permitirá conocer el área bajo la
curva de Raylaight:
x
D s−i
−x
WS−i
… … … … fórmula( 14 )
a) Primer valor
x
DS− A
De la Gráfica 3:
A
x
WS− A
x
D− A
−x
WS− A
b) Segundo valor
x
DS−B
De la Gráfica 4:
B
x
WS−B
x
D−B
−x
WS−B
c) Tercer valor
x
DS−C
De la Gráfica 5:
C
x
WS−C
x
D S−C
−x
WS−C
d) Cuarto valor
x
DS−D
De la Gráfica 6:
D
x
WS−D
x
D S−D
−x
WS−D
e) Cuarto valor
x
DS−E
De la Gráfica 7:
E
x
WS−E
x
D S−E
−x
WS−E
f) Cuarto valor
x
DS−F
De la Gráfica 8:
F
x
WS−F
x
D S−F
−x
WS−F
0.05 0.055 0.06 0.065 0.07 0.075 0.08 0.085 0.
0
1
Gráfica 10. Método del Trapecio
Composición de la fase líquida del hervidor, fracción mol (Xw,EtOH)
1/(XD,A-XW,A)
b) Obtenemos la ecuación de la pendiente de la función con el fin de facilitar
los cálculos para obtener las bases de los trapecios que vamos a calcular
para obtener el área de Rayleight (No se usará la integral, sino el método
del trapecio):
y=3.2705 x +1.1814 … … … … ecuación( 1 )
c) Comenzamos con el método del trapecio, sustituyendo los datos:
x
D−RT
−x
w 3
¿ x
DS−i
… … … … fórmula( 15 )
=1.43 x 10
− 3
x
I −i+ 1
=x
I −i
Para cada x I-i
x
I − 1
=0.07187+1.43 x 10
− 3
x
I − 2
=0.0733+1.43 x 10
− 3
x
I − 3
=0.07473+1.43 x 10
− 3
x
I − 4
=0.07616+1.43 x 10
− 3
x
I − 5
=0.07759+1.43 x 10
− 3
x
I − 6
=0.07902+1.43 x 10
− 3
Para cada Base mayor “B”:
y
I − 1 B
y
I − 2 B
y
I − 3 B
y
I − 4 B
y
I − 5 B
y
I − 6 B
Para cada Base menor “b”:
y
I − 1 B
y
I − 2 B
( 1.4445+1.4398)∗(1.43 x 10
− 3
=2.06227 x 10
− 3
u
2
Área Total
TOTAL
= A 1 + A 2 + A 3 + A 4 + A 5 + A 6 … … … … fórmula( 18 )
T
=( 2.0288+2.03553+2.04218+2.04883+2.05555+2.06227 ) x 10
− 3
u
2
TOTAL
=12.2731 x 10
− 3
u
2
e) Cantidad de Residuo que se queda en el hervidor con la ecuación de
Rayleigh
t
cal
RT
∗exp
(
∫
x
W 3
, 1
x
WRT
, 1
d x
W 1
x
D
, 1 −x
W
)
… … … … ecuación( 2 )
t
cal
=( 1.974348313 kmol )∗exp (−12.7316 x 1 0
− 3
)=1.949371 kmol
permanecen al final de la operación del hervidor
a) Usar la altura medida en el indicador de nivel del hervidor y convertir a
volumen V0, pasar este a masa F empleando la densidad de la mezcla
inicial. Enseguida con la composición mol de etanol, estimar el peso
molecular promedio inicial de la carga y los Kmol iniciales:
∆ h=30.4 cm
ρ
0
g
ml
x
0 , 1
0
kg
mol
Con el Diagrama 2:
0
0
0
∗ρ
0
0
… … … … fórmula( 19 )
0
(
kg
)
kg
kmol
=2.02308203 kmol
b) Calcular los kmol de la muestra extraída del hervidor para conocer la
composición de la carga inicial:
0 muestra
0 muestra
0 muestra
∗ρ
0
0
… … … … fórmula( 20 )
0 muestra
(
kg
)
kg
kmol
=8.092328 x 1 0
− 3
kmol
c) Calcular los kmol de la muestra extraída del hervidor para conocer la
composición del líquido remanente al estabilizarse el sistema a reflujo
total:
W RT
kg
kmol
LRT
muestra
v
WRT muestra
∗ρ
WRT
WRT
… … … … fórmula( 21 )
LRT muestra
(
kg
l
)
kg
kmol
=7.227994 x 1 0
− 3
kmol
d) Calcular los kmol de la muestra extraída del destilado para conocer la
composición del reflujo al estabilizarse el sistema a reflujo total:
LRT
kg
kmol
LRT muestra
LRT
muestra
∗ρ
LRT
LRT
… … … … fórmula( 22 )
LRT
muestra
(
kg
l
)
kg
kmol
=2.9264715 x 1 0
− 3
kmol
e) Calcular los kmol de la muestra extraída del destilado para conocer la
composición del Líquido remanente correspondiente al corte 3 de destilado
W 3
kg
kmol